
肝硬化 症狀、前兆、肝硬化腹水、分級、原因、飲食、治療
目录
肝硬化初期前兆常被忽略,如易疲勞、消化不良等症狀。肝硬化分級依Child-Pugh評估嚴重程度,常見原因包含B型肝炎、酗酒及脂肪肝。晚期可能出現肝硬化腹水等併發症,治療需結合藥物與飲食控制(低鈉高蛋白)。肝硬化存活率與發現早晚相關,5年存活率約50-70%。日常需嚴格戒酒並配合醫師治療,透過正確飲食管理與定期追蹤,能有效延長肝硬化壽命!
一、肝硬化概述
肝硬化(Liver Cirrhosis)是一種慢性進行性肝病,其病理特徵為肝實質細胞廣泛壞死後,殘存肝細胞結節性再生與纖維組織增生,導致正常肝小葉結構破壞和假小葉形成。此疾病發展至末期將引起門靜脈高壓和肝功能衰竭,屬於不可逆的病變過程。根據世界衛生組織統計,肝硬化在全球死亡原因中排名第11位,每年約造成100萬人死亡。
從組織學角度來看,肝硬化可分為三種類型:小結節型(結節直徑3mm)以及混合型。此分類與病因和病程進展速度密切相關,例如酒精性肝硬化多表現為小結節型,而病毒性肝炎引起的肝硬化則常呈大結節型。
二、肝硬化症狀表現
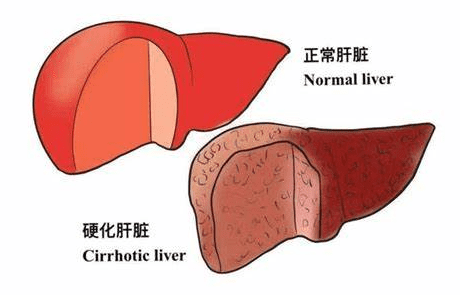
肝硬化患者的臨床症狀與疾病分期密切相關。早期肝硬化(代償期)可能僅表現為非特異性症狀,而隨著疾病進展(失代償期),會出現更明顯的肝功能異常表現。
1. 代償期肝硬化症狀
此階段患者可能僅有輕微不適,包括:疲勞倦怠(約60-70%患者)、右上腹不適或脹滿感、食慾減退、體重減輕等。值得注意的是,約20-30%的代償期肝硬化患者可能完全無症狀,僅在例行檢查中發現異常。
2. 失代償期肝硬化症狀
當肝功能儲備進一步惡化,會出現典型症狀群:黃疸(血清總膽紅素>2mg/dL)、凝血功能異常(PT延長>3秒)、腹水形成、肝性腦病變(從輕度意識混亂到昏迷)、脾功能亢進(血小板減少
三、肝硬化前兆警示
識別肝硬化前兆對於疾病管理至關重要。以下臨床表現應高度警惕肝硬化的可能:
長期不明原因的疲勞感,特別是伴隨食慾下降;肝功能檢查中γ-GT和AST/ALT比值>1的持續異常;超音波檢查顯示肝實質回聲增粗或不均勻;血小板計數進行性下降(
四、肝硬化腹水的病理與處理
腹水是肝硬化失代償期最常見的併發症之一,約50%的代償期患者在10年內會進展為腹水。其形成機制主要涉及門靜脈高壓(壓力>10mmHg)、低白蛋白血症(血清白蛋白
臨床處理遵循階梯式策略:首選限鈉飲食(每日鈉攝入
五、肝硬化分級系統
臨床上常用Child-Turcotte-Pugh(CTP)和終末期肝病模型(MELD)兩種評分系統來評估肝硬化嚴重程度和預後。
1. Child-Pugh分級
將患者分為A(5-6分)、B(7-9分)、C(10-15分)三級。評分參數包括:總膽紅素、血清白蛋白、凝血酶原時間延長、腹水程度以及肝性腦病分期。A級患者1年存活率約95%,B級約80%,而C級僅約45%。
2. MELD評分
計算公式為:3.78×ln[總膽紅素(mg/dL)] + 11.2×ln[INR] + 9.57×ln[肌酐(mg/dL)] + 6.43。MELD評分>15分提示需要考慮肝移植評估。此系統在預測3個月死亡率方面準確度達80%以上,尤其適用於等候肝移植患者的優先排序。
六、肝硬化原因
肝硬化原因具有地域差異性,在台灣地區主要成因包括:
1. 病毒性肝炎
B型肝炎(約佔40-50%)和C型肝炎(約20-30%)是最主要的病因。HBV感染者發展為肝硬化的年發生率約2-5%,而HCV感染者則為1-3%。值得注意的是,合併HDV感染會顯著加速肝硬化進程。
2. 酒精性肝病
長期酗酒(男性>60g/天,女性>40g/天,持續10年以上)約有15-20%會進展為肝硬化。酒精代謝產物乙醛可直接誘導肝星狀細胞活化,促進膠原沉積。
3. 非酒精性脂肪性肝病(NAFLD)
隨著肥胖和代謝症候群流行,NAFLD相關肝硬化比例逐年上升。組織學表現為非酒精性脂肪性肝炎(NASH)的患者,10-15年內肝硬化發生率約15-25%。
4. 其他病因
包括原發性膽汁性膽管炎(PBC)、自體免疫性肝炎、遺傳性血色病、Wilson病以及藥物/毒素誘導性肝損傷等。
七、肝硬化存活率與預後因素
肝硬化患者的生存時間與疾病分期、併發症控制以及病因是否可逆密切相關。代償期肝硬化5年存活率可達80-90%,而失代償期則下降至30-50%。影響預後的主要負面因素包括:頑固性腹水、自發性細菌性腹膜炎(死亡率約20-30%)、肝腎症候群(1型患者中位生存期僅2周)、反覆食管靜脈曲張出血以及嚴重肝性腦病。
值得關注的是,戒酒可使酒精性肝硬化5年生存率從30%提高至60%;而成功抗病毒治療(如HBV患者接受長期恩替卡韋治療或HCV患者達成SVR)可顯著延緩疾病進展,甚至部分逆轉肝纖維化。
八、肝硬化壽命評估
對於確診肝硬化的患者,壽命預測需綜合多種指標:
Child-Pugh A級患者中位生存期約15-20年;B級約5-8年;C級僅1-3年。MELD評分每增加1分,3個月死亡風險增加約8%。合併HCC的肝硬化患者5年生存率不足20%。肝移植術後5年存活率現已達70-80%,成為終末期肝硬化最有效的治療手段。
需要特別強調的是,早期識別和干預可改變病程的危險因子(如戒酒、控制代謝症候群、抗病毒治療)可顯著改善長期預後。定期監測(每6個月肝超音波和AFP檢查)對早期發現HCC至關重要。
九、肝硬化飲食管理原則
營養不良在肝硬化患者中發生率高達65-90%,肝硬化飲食干預可改善預後:
1. 蛋白質攝入
傳統限制蛋白質觀念已被修正,現建議每日攝入1.2-1.5g/kg高生物價蛋白(如乳清蛋白)。僅在肝性腦病急性期短暫限制蛋白質(0.5g/kg/day),症狀改善後應逐步恢復。
2. 熱量供應
需維持每日35-40kcal/kg,以防止肌肉消耗。夜間加餐(含50g碳水化合物)可減少蛋白質分解。
3. 微量營養素
重點關注鋅(改善味覺和氨代謝)、維生素D(預防骨病)以及水溶性維生素的補充。限制鈉攝入(
4. 特殊狀況處理
對於食管靜脈曲張患者應避免粗糙食物;糖尿病合併肝硬化者需個體化調整碳水化物比例;肥胖相關肝硬化仍建議適度減重(目標5-10%)。
十、肝硬化治療進展
現代肝硬化治療採取多學科綜合管理模式:
1. 病因治療
抗病毒治療(如恩替卡韋、替諾福韋治療HBV;直接抗病毒藥物治療HCV)可阻斷疾病進展。酒精性肝硬化嚴格戒酒可使3年生存率提高50%。
2. 抗纖維化治療
目前尚無特異性抗纖維化藥物,但研究顯示己酮可可鹼、血管緊張素受體阻斷劑可能有一定效果。維生素E被推薦用於NASH相關肝硬化。
3. 併發症管理
非選擇性β受體阻斷劑(如普萘洛爾)用於初級預防靜脈曲張出血;利福昔明聯合乳果糖控制肝性腦病;特利加壓素治療肝腎症候群。
4. 肝移植評估
當MELD評分>15或出現肝功能失代償表現時應啟動移植評估。活體肝移植的5年存活率現已與屍肝移植相當。
5. 新興療法
幹細胞移植、生物人工肝支持系統以及靶向抗纖維化藥物(如LOXL2抑制劑)正在臨床試驗中,可能為未來治療帶來新選擇。
肝臟研究院團隊溫馨提醒:肝硬化作為慢性肝病的終末階段,其防治需要長期綜合管理。早期識別高風險人群、積極控制可逆病因、規範化處理併發症以及適時進行肝移植評估,是改善患者預後的關鍵策略。未來隨著抗纖維化治療和肝再生醫學的發展,有望為肝硬化患者帶來更多治療選擇。
Calendar
| 一 | 二 | 三 | 四 | 五 | 六 | 日 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |||
| 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| 26 | 27 | 28 | 29 | 30 | 31 | |
發佈留言